El efecto invernadero: una pequeña revisión de los fenómenos físicos y químicos implicados
Introducción
La atmósfera, junto con la energía del sol y la abundancia de agua, es una de las características que permiten la existencia de la vida en la Tierra. Ésta, además de servir como un escudo que refleja la radiación de alta energía que llega al planeta, es responsable de mantener una temperatura uniforme y moderada en su superficie[1]. Ésto es posible gracias a los gases de efecto invernadero (GEI), moléculas de agua (H2O), dióxido de carbono (CO2), ozono (O3), metano (CH4) y compuestos clorofluorocarburos (CFC) que atrapan a la radiación infrarroja que abandona la Tierra de un modo parecido al de los cristales de los invernaderos, virtud por la cual a este proceso se le llama “efecto invernadero” [2]. Sin éste, el planeta dependería únicamente del 48% de la energía que absorbe durante el día, la cual, ante el rápido enfriamiento del planeta, sería apenas suficiente para mantener una temperatura de -19 oC, impidiendo así la manutención de la temperatura atmosférica durante la noche [3].
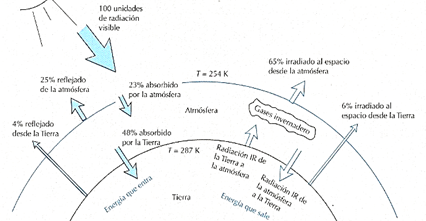
Situación actual
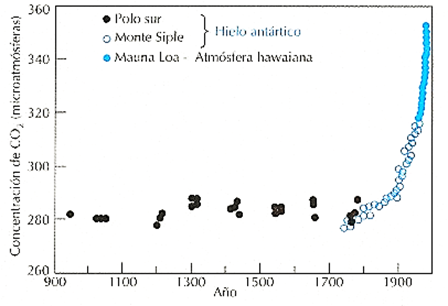
En tiempos recientes, los combustibles fósiles han sido responsables de la emisión de 22 billones de toneladas de CO2 anuales, aumentando su concentración atmosférica a un valor de 386 mg/L, concentración que, tal y como se muestra en la Figura 2, es un 30% mayor al valor de 280 ppm que se solía mantener hasta antes de la Revolución Industrial, y que se espera que se duplique entre el 2050 y el 2100 [4, 5]. Ésto ha provocado un aumento drástico en la absorción de la radiación infrarroja, lo cual ha impedido su dispersión fuera de nuestra atmósfera, calentándola entre 0.3 y 0.6 oC con respecto al siglo anterior [1]. El mecanismo por el cual esto ocurre será explicado a continuación.
Fundamento
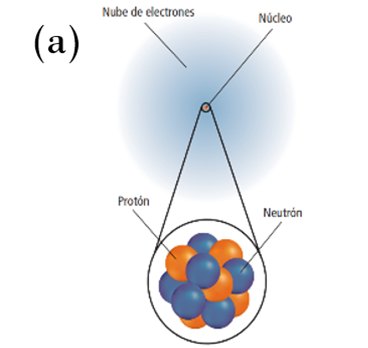
La atmósfera, igual que toda la materia del universo, está hecha de unos pequeños bloques de construcción llamados átomos. Tal y como se ilustra en la Figura 3, éstos son núcleos cargados positivamente rodeados por una “nube” de electrones cargados negativamente. Cuando reaccionan, sus átomos chocan y sus nubes electrónicas interactúan, de modo que sus electrones más externos se reacomodan hasta que la sección más externa de cada átomo tenga ocho electrones. Como resultado, se crea una interacción de gran atracción denominada “enlace químico” [6].
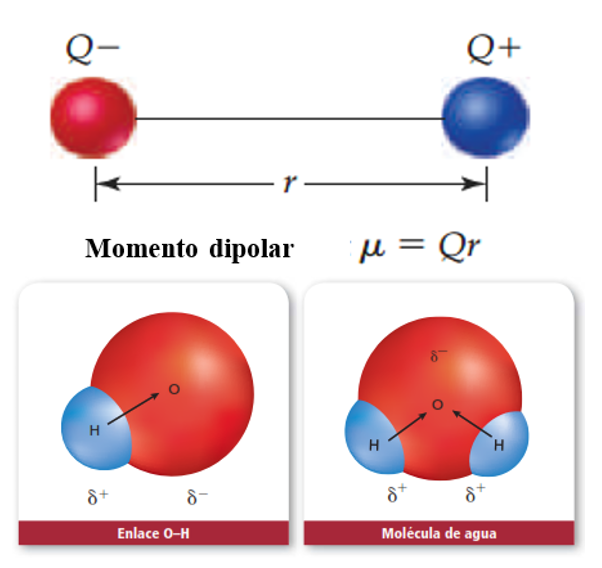
Ya dentro de los enlaces, los átomos comparten sus electrones de una manera que puede o no ser equitativa, ya que cada uno tiene una capacidad distinta para atraer a los electrones hacia sí mismos (electronegatividad): los átomos más electronegativos atraen a los electrones con mayor fuerza [7]. Básicamente, el enlace es como un juego de tira y afloja, ya que la fuerza desigual ejercida sobre los extremos de la cuerda acerca el centro hacia el equipo con los jugadores más fuertes. Del mismo modo, y como se puede observar en la Figura 4, si la diferencia de electronegatividad es grande, se produce una transferencia parcial de electrones capaz de generar dos polos de cargas iguales y opuestas [1]. A esta configuración se le conoce como dipolo magnético, y tiene una fuerza dada por su momento dipolar permanente (µ), el cual depende de la longitud de enlace y del grado de transferencia de carga entre los átomos [8].
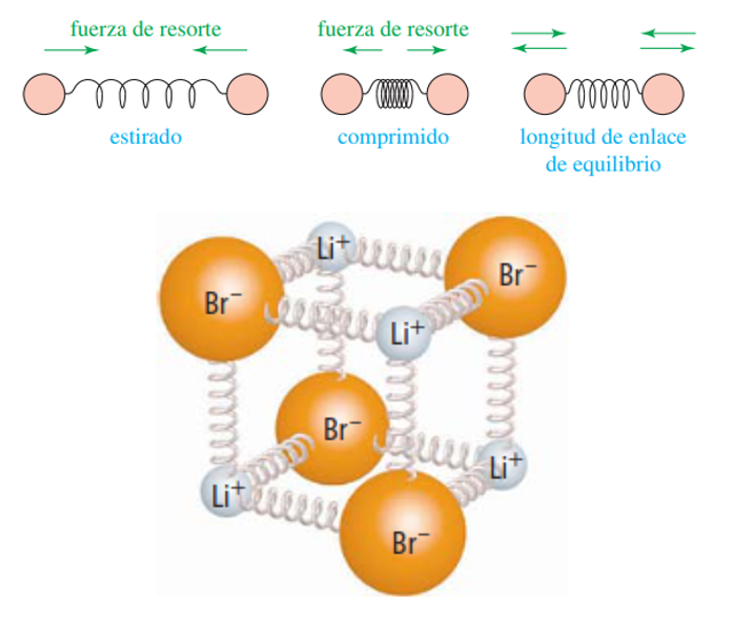
Existe un pequeño problema con la descripción anterior, y es que como señala la Figura 5, los enlaces entre los átomos se comportan como resortes, es decir, se pueden estirar y contraer hasta el punto en el que una fuerza de restauración haga que se junten y se separen, respectivamente, hasta recuperar su posición de equilibrio [9]. A este fenómeno se le llama “vibración molecular”, y se caracteriza por provocar una leve modificación en la distancia enlazante capaz de alterar el solapamiento de las nubes electrónicas y, en consecuencia, el grado de transferencia de carga. Como resultado, se da un cambio periódico en el momento dipolar de las moléculas conforme éstas vibran, generando así un momento dipolar dinámico de mucha menor magnitud al permanente [10].
La luz del Sol, al ser una onda electromagnética, está compuesta por un campo eléctrico capaz de interactuar con los dipolos de las moléculas del mismo modo al mostrado en la Figura 6: si el campo y el momento dipolar están en la misma dirección, el enlace se comprime y su momento dipolar disminuye; si se oponen, el enlace se estira y su momento dipolar aumenta [9]. Así, las moléculas con momentos dipolares pueden absorber la energía del Sol si la frecuencia de su radiación es similar y está en fase con su frecuencia vibracional, la cual se encuentra en la parte infrarroja del espectro electromagnético [10]. Entonces, la radiación absorbida induce a las moléculas a transitar hacia un estado vibracional excitado en el que se estimula el estiramiento de los enlaces, aumentando así la amplitud de sus oscilaciones, y con ello, su energía. Pasado un tiempo, las moléculas se “cansan” y decaen hacia un nivel de energía inferior, y en consecuencia, se emite de vuelta la misma cantidad de energía absorbida mediante colisiones con otras moléculas, liberando así calor por todo el entorno [3].
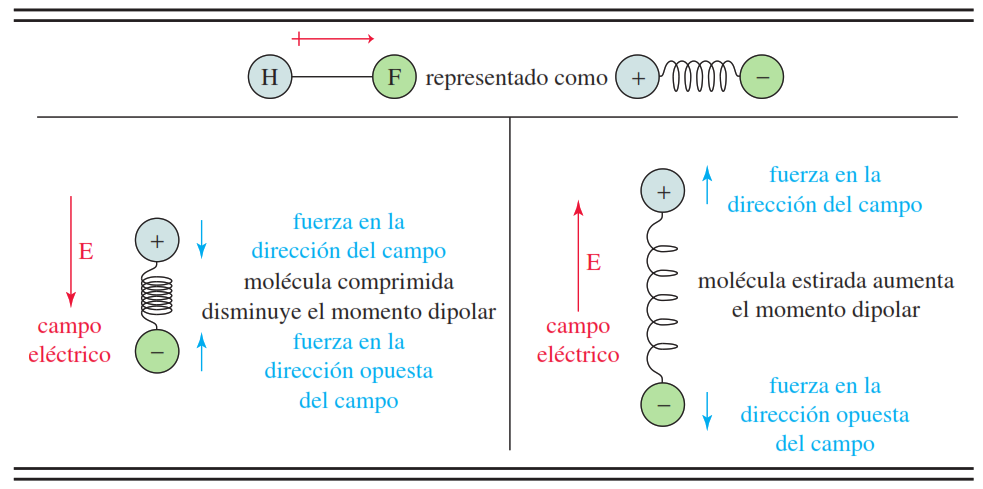
Hay que aclarar que no todas las vibraciones moleculares absorben radiación infrarroja, y es que únicamente las vibraciones de los enlaces con momentos dipolares resultan en absorciones infrarrojas. Ésto se debe a que las moléculas con un momento dipolar nulo poseen una vibración de estiramiento débil o inexistente incapaz de producir cambios en el momento dipolar, por lo que el campo eléctrico no puede interactuar y, por ende, imposibilita la absorción de energía [9].
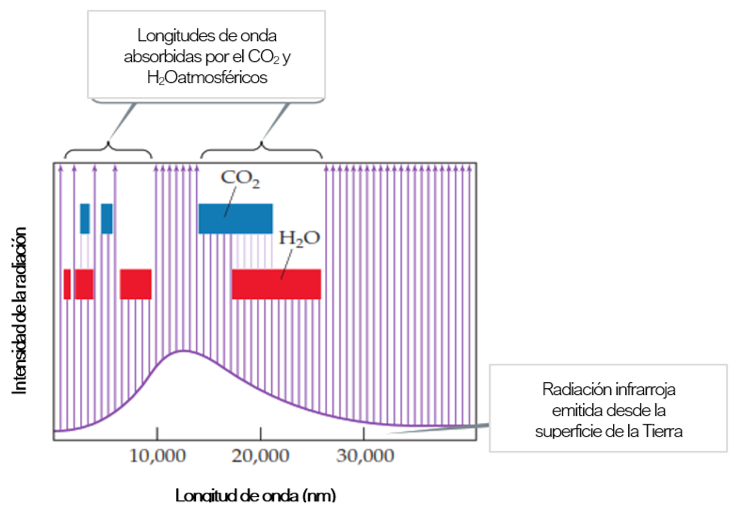
Este comportamiento de los compuestos tiene importantes consecuencias, ya que, tal y como la Figura 7 nos muestra, la atmósfera tiene pequeñas concentraciones de gases de efecto invernadero, cuyas moléculas poseen momentos dipolares dinámicos capaces de absorber la radiación infrarroja emitida por la Tierra y de emitirla más tarde como calor. Es así como la presencia de dichos gases permite que la atmósfera se comporte como una manta aislante que mantiene la temperatura terrestre en 20oC, pero que también le otorga el potencial de agravar el cambio climático ya presente en el planeta si las emisiones de éstos continúan de forma indiscriminada [2].
Conclusión
En resumen, los “GEI” generados por la actividad humana han provocado un incremento pronunciado en la actividad del efecto invernadero, situación que ha convertido al cambio climático en una preocupación real para los estudiosos del tema, quienes predicen que, de seguir así, la concentración de CO2 irá aumentando por más de 2 ppm al año, lo cual es probable que provoque que la temperatura de la Tierra aumente entre los 2 oC y los 5 oC en las décadas siguientes [4, 11].
Para evitar ésto, mucha investigación se está haciendo para encontrar formas de atrapar a los “GEI” y resguardarlos bajo tierra, así como para desarrollar nuevos métodos que permitan usarlos como materias primas [12]. Entretanto, nosotros podemos ayudar con acciones tan sencillas como no dejar en “espera” a nuestros dispositivos electrónicos, aumentar la temperatura operativa de refrigeradores y aires acondicionados, o bien, reducir el uso de nuestros vehículos [13].
Referencias
- Brown, T. L, LeMay, H. E., Bursten, B. E., Murphy, C. J., & Woodward, P. M. (2017). Química del medioambiente. En C. Hess (Ed.) Química: la ciencia central (14a ed., pp. 780-783). Pearson Educación.
- Lacis, A., Hansen, J., Lee, P., Mitchell, T., & Lebedeff, S. (1981). Greenhouse effect of trace gases, 1970-1980. Geophys. Res. Lett., 8(10), 1035–1038. doi:10.1029/gl008i010p01035
- Harris, D. C. (2001). Espectrofotómetros. En V. Berenguer & A. Berenguer (Eds.) Química analítica cuantitativa (2a ed., pp. 567). Editorial Reverté.
- Stern, N. (2007). The Economics of Climate Change. Cambridge University Press.
- Sarmiento, J. (1993). Ocean carbon cycle. Chem. Eng. News, 71(22), 30-43. doi:10.1021/cenv07n022.p030
- Philips, J. S., Strozak, V. S., Wistrom, C., & Zike, D. (2012). Química: conceptos y aplicaciones. McGraw-Hill.
- Housecorft, C. E., & Sharpe A. G. (2005). Inorganic Chemistry. Pearson Education.
- Halliday, D., Resnick, R., & Krane, K. S. (1992). Física (4a ed., Vol. 2, pp. 19-37). Compañía Editorial Continental.
- Wade, L. G., & Simek, J. W. (2017). Espectroscopía infrarroja y espectroscopía de masas. En Quimica organica (9ª ed., pp. 559-562). Cenage Learning.
- Engel, T., & Reid, P. (2006). Espectroscopía vibracional y rotacional de moléculas diatómicas. En M. Martín (Ed.) Química física (1a ed., pp. 405-416). Pearson Educación.
- Olivo, M. L., & Soto, A. (2010). Comportamiento de los gases de efecto invernadero y las temperaturas atmosféricas con sus escenarios de incremento potencial. Universidad, Ciencia y Tecnología, 14(57), 221-230. http://ve.scielo.org/scielo.php?script=sci_arttext&pid=S1316-48212010000400002&lng=es&tlng=es.
- Lal, R. (1997). Residue management, conservation tillage and soil restoration for mitigating greenhouse effect by CO2-enrichment. Soil tillage res., 43(1-2), 81–107. doi:10.1016/s0167-1987(97)00036-6
- Gobierno Vasco (30 de abril de 2018). Consejos para reducir tus emisiones de gases de efecto invernadero. Página web del Departamento de Desarrollo Económico, Sostenibilidad y Medio Ambiente del País Vasco. t.ly/gnOpM

